2022年4月28日,广东省智能科学与技术研究院石云课题组(认知神经网路与可塑性研究组)在Nature 子刊,精神病学领域旗舰学术期刊《分子精神病学》(Molecular Psychiatry,IF=15.992)在线发表了题为《Enhancing GluN2A-type NMDA receptors impairs long-term synaptic plasticity and learning and memory》的科研论文, 揭示了谷氨酸受体突变损害认知和突触可塑性的新分子机制。
脑内神经信号在神经元之间的交换依赖于谷氨酸和谷氨酸受体。突触前神经元释放的信号分子谷氨酸结合并激活突触后膜的NMDA型谷氨酸受体,介导离子的流动,提升神经元胞内的Ca2+浓度,引起神经突触的强度变化----依据神经元和突触本身的活动或增强(LTP)、或减弱(LTD),这种细胞反应称为突触可塑性。突触的可塑性变化被认为是认知、学习和记忆、遗忘等神经功能的细胞学基础。NMDA受体因而在认知中起关键作用。
在脑内,NMDA受体主要分为GluN2A和GluN2B两种类型。这两种类型的NMDA受体在通道动力学上有所不同,GluN2A失活比GluN2B快,其介导的Ca2+信号相对较弱。课题组在一个智力发育迟缓的儿童发现了GluN2A的一个罕见突变(K879R),即879位点的赖氨酸(K)突变成了精氨酸(R)。由于赖氨酸和精氨酸都是机体内带正电的碱性氨基酸,该突变看起来不改变GluN2A受体的通道性质,实验验证了这个预测。然而879位点的赖氨酸残基位于一个KKK879-881的赖氨酸三联体上,研究表明该赖氨酸三联体是一个内质网滞留信号,其作用是减缓新合成的GluN2A受体运输到细胞膜上。K879R突变破坏了这个信号,因而受体的上膜运输加快,在细胞膜上的GluN2A受体增多(图1)。
为进一步理解该突变是否以及如何导致认知的障碍,课题组制作了GluN2A_K879R的突变敲入小鼠,即在小鼠的基因组里引入一个点突变,模拟病人的基因突变。行为学分析发现,突变小鼠的学习与记忆能力下降了。生化和电生理分析表明突变小鼠的GluN2A受体在神经元细胞膜以及突触膜上的表达和功能都增强了。有趣的是,伴随着GluN2A在细胞膜上的表达增强,GluN2B在细胞膜和突触上的表达及功能却减弱了。这可能是一种互补抑制机制。同时也观察到AMPA型谷氨酸受体 GluA1在突触膜的表达和功能减弱。实验证明谷氨酸受体的这些变化造成了突触可塑性的损伤:在诱导突触增强(LTP)的实验条件下,突变小鼠的LTP诱导不出来;在诱导突触减弱(LTD)的实验条件下,突变小鼠的LTD也诱导不出来。因此,这项研究发现了一个导致突触可塑性损伤和认知缺陷的新机制(图2)。
该研究的创新发现可以总结为以下几点:1. 在GluN2A受体上发现了一个新的内质网滞留信号。2. GluN2A受体在细胞膜上的表达增强,导致GluN2B受体表达互补性地减弱。3.GluN2A受体增强引起GluA1受体的减少。4.GluN2A在突触表达和功能的增强破坏突触的可塑性。5.GluN2A的增强损伤认知能力。
该研究工作受到国家自然科学基金,科技部重大专项项目和广东省智能科学与技术研究院高水平创新研究院建设项目(广东省科技创新战略专项资金)等基金的支持。
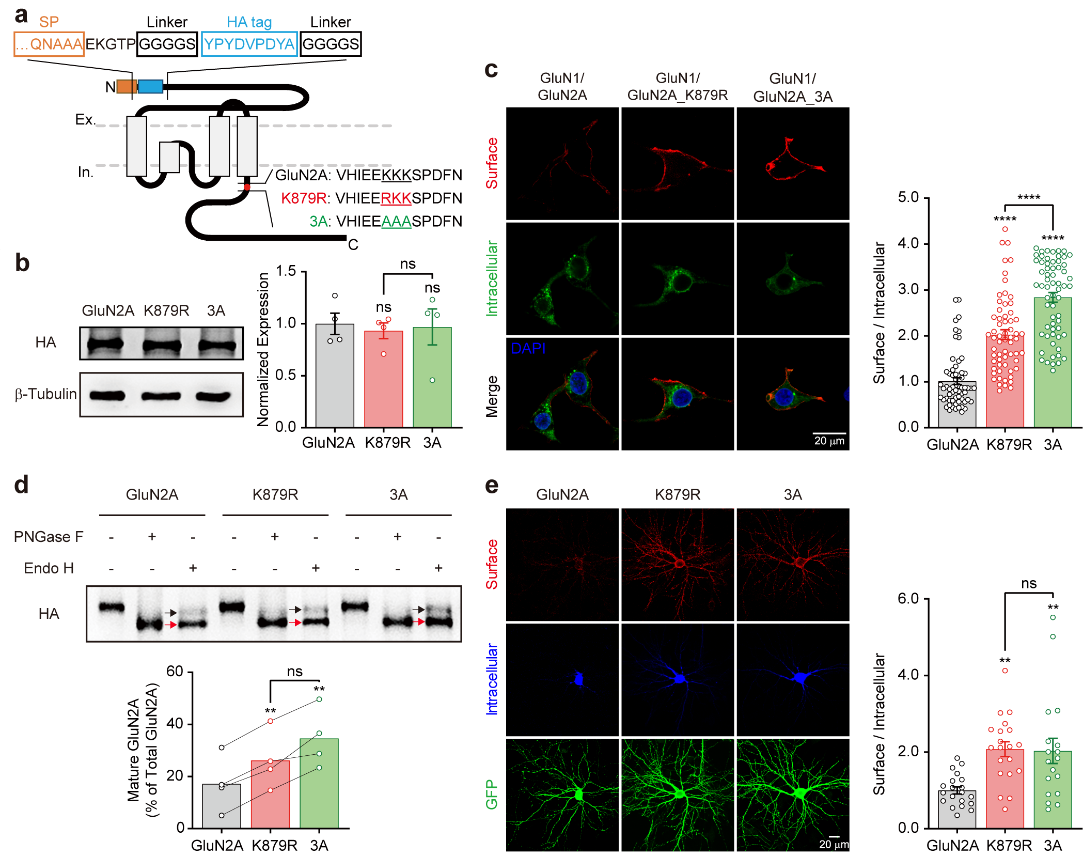
图1. 在智力发育迟缓的病人中找到一个基因突变(GluN2A_K879R),该突变造成GluN2A-NMDA受体上膜加快,在膜上的表达升高。
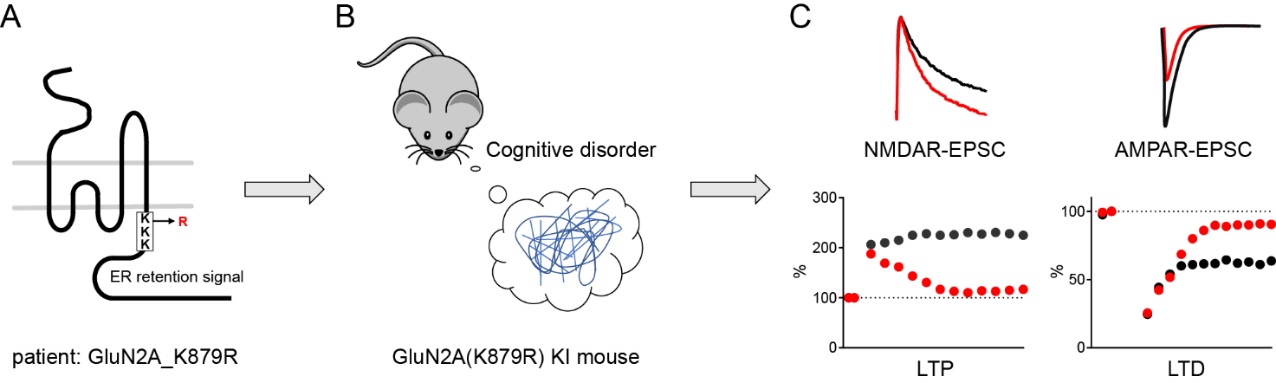
图2:A. 病人中发现的罕见突变。B. 基因敲入小鼠认知能力减弱。C. 基因敲入小鼠NMDA受体功能的变化,AMPA受体功能的变化,突触可塑性的损伤。
原文链接:https://doi.org/10.1038/s41380-022-01579-7


