2022年8月10日,广东省智能科学与技术研究院(以下简称广东省智能院)丘志海实验室(多尺度神经网络成像和操控研究组)与香港理工大学孙雷实验室在脑刺激和脑调控领域顶级期刊《脑刺激》(Brain stimulation)在线发表题为“Sonognetics: recent advances and future directions”的综述论文。该论文从原理、细胞水平和动物水平研究对超声遗传学技术进行了梳理和总结,对下一步需要解决的问题做了展望。
超声遗传学借鉴光遗传学策略,利用超声波激活超声敏感通道蛋白,从而控制特定神经元的活动。超声波是一种频率为亚 MHz 到几 MHz的机械波,可以无创地穿过生物组织。因为它的安全性及高时空分辨,超声波长期以来被用于成像。越来越多的证据表明低强度超声会产生各种生物效应,为癌症治疗、骨愈合、基因和药物输送以及神经调控等新应用铺平了道路。
声遗传学的第一个部件是超声波。由压电材料在一定频率和电压下驱动产生的超声波可以通过引发高达~20 nm的粒子位移在弹性粘性介质中传播。超声波的传播可以主动或被动地形成基于驻波、吸收和组织声学特性梯度的声压梯度,并向介质引入称为超声辐射力的非零净力。利用声辐射力来激活神经元的优点是显而易见的:1) 在生物系统中使用超声波是安全的;2) 超声波的传播快速且易于控制,尤其是使用阵列系统,其中可以对超声焦点进行编程,以根据需要创建特定的时空模式。超声波可以作为一种独特的激发源,以定义的时空模式控制整个大脑的神经活动。
声遗传学的第二个组成部分是超声敏感通道蛋白。 2008 年首次发现超声波可以通过激活膜通道来诱导突触传递。超声波对神经元的调控机制假设是,压力可以使细胞膜变形以间接产生通道结构的构象变化,或直接作用于通道成分以产生跨膜的离子梯度。最近的一项研究表明,当超声波使细胞膜偏转时,它通过激活机械敏感离子通道来诱导神经去极化。最近,多种通道类型被证明可以在离体条件下被超声激活,例如双孔钾(K2P)家族(TREK-1,TREK-2和TRAAK),压电家族(Piezo1和 Piezo2)和 TRP 家族(TRPA1、TRPC1、TRPP2、TRPM4 和 TRPV1)。尽管尚不清楚哪些通道起主导作用,但这些发现为使用机械敏感离子通道作为声控开关开发声遗传学奠定了坚实的基础。
文章探讨了超声遗传学的机制,着重对基于MscL-G22s、Prestin以及TRP通道的超声遗传学研究进行了深入的探讨。对比了各个技术的优缺点,及其特性,包括时空分辨率、选择性和特异性等。目前的挑战包括:存在可能的听觉干扰问题、安全性问题以及寻找抑制性超声遗传学通道蛋白等。将来的方向包括:开拓计算超声遗传学、无创超声敏感通道蛋白的特异性表达以及拓展其在非人灵长类中的应用等。
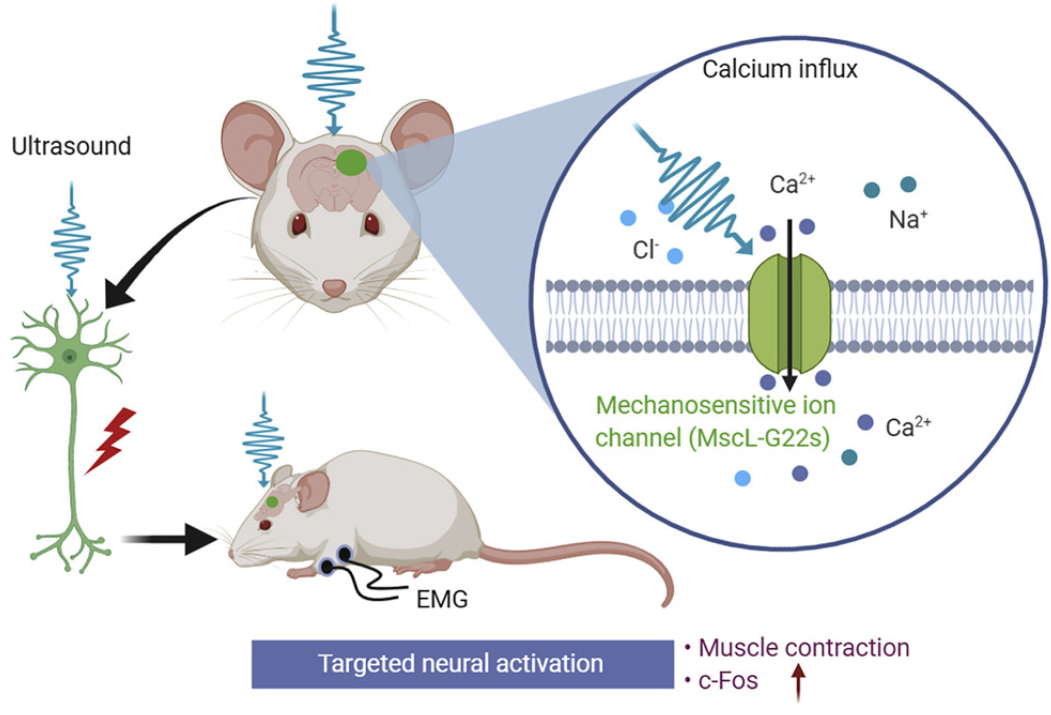
基于MscL-G22s的超声遗传学技术
广东省智能院实习生刘天燚为本文第一作者,广东省智能院的丘志海研究员和香港理工大学的孙雷教授为论文的共同通讯作者,广东省智能院为第一通讯单位。该项工作得到了斯坦福大学Mihyun Choi博士和西安电子科技大学费春龙教授的合作和支持,并获得广东省高水平创新研究院项目资助以及香港科技创新局等多项基金的支持。
文章链接:https://www.sciencedirect.com/science/article/pii/S1935861X22002066


