脊椎发育研究新进展
《Cell Research》刊发论文
2024年1月5日,广东省智能科学与技术研究院(简称:智能院)时颖超研究员(神经细胞图谱与认知网络研究组)和北京师范大学王晓群教授、吴倩教授在国际著名学术期刊《Cell Research》(细胞研究)上发表了题为“Decoding the spatiotemporal regulation of transcription factors during human spinal cord development”的论文,该研究建立了一种解码转录因子(TF)表达的空间转录组方法(TF- seqFISH),并综合单细胞转录组测序及10x Visium空间转录组等技术手段,绘制了胚胎期人类脊髓发育的时空转录组图谱,系统解析了人脊髓发育的时空特征和调控机制。


该研究建立了一种解码转录因子表达的
空间转录组方法

脊髓作为中枢神经系统的重要组成部分,是连接大脑和周围神经的重要桥梁。脊髓对于机体感知刺激及与环境互动至关重要。一方面它通过背角神经元接受来自皮肤、肌肉和内脏器官的感觉信息并传递给高级中枢;另一方面它通过腹角的运动神经元执行运动指令。脊髓复杂多样的细胞构成是实现感觉及运动功能的基础。脊椎动物脊髓的细胞命运决定受到严格的时空调控,以确保精确无误地建立神经回路。探究脊髓发育的时空调控机制对于研究发育障碍疾病及为脊髓损伤提供治疗思路有重要意义。虽然在小鼠及鸡等模式动物中进行了大量的研究,人类脊髓发育的时空调控机制尚知之甚少。
转录因子对于调控脊髓发育至关重要。为了解析转录因子在人脊髓发育过程中的空间表达规律,经过多年攻关,团队研发出了基于单分子成像的单细胞空间转录组技术TF-seqFISH(Transcription Factor sequential Fluorescence In Situ Hybridization),该技术可以检测人1085个转录因子的mRNA在单个细胞中的亚细胞定位和表达量 (图 1)。在此基础上,应用TF-seqFISH结合基于10x Visium的空间转录组数据,以及涵盖了人脊髓发育多个时期的单细胞转录组数据,提供了单个细胞和基因表达的空间位置信息,从而为探究人脊髓发育的时空调控机制提供了宝贵的数据基础。
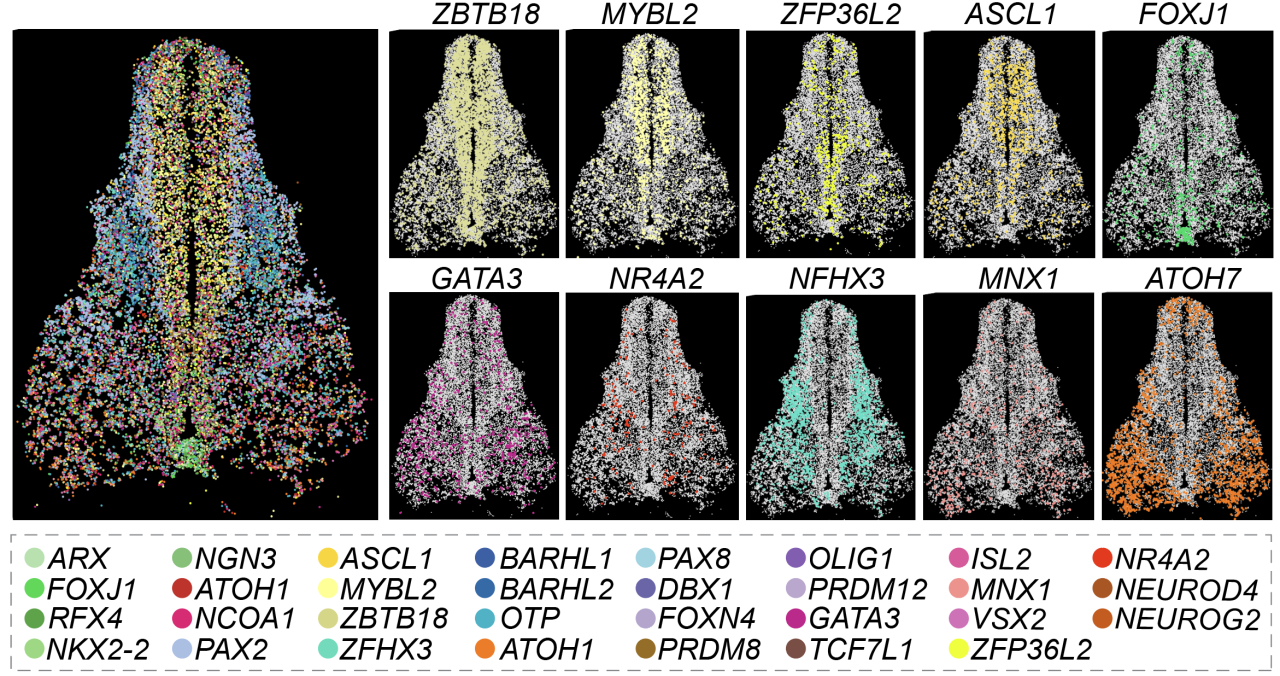
TF-seqFISH高质量检测转录因子的空间定位及表达量
本研究发现发育期VZ区的人脊髓神经祖细胞并不是匀质的,而是呈现出了多样的分子特征且沿背腹轴有序分布。基于经典基因的表达模式以及发育轨迹分析的结果,作者在scRNA-seq数据中定义出了不同的神经祖细胞和神经元亚型,并确定了其谱系对应关系。TF-seqFISH提供了一个解析转录因子的空间表达模式的良好平台。借助于TF- seqFISH和scRNA-seq数据的联合分析,研究人员进一步阐明了不同的神经祖细胞亚型沿背腹轴的空间分布模式(dp1 dp2 dp3-6 p0/1 pMN p2/3)(图 2)。另外,本研究也解析了在内外轴方向上进行的神经发生、分化、迁移及成熟等过程 。
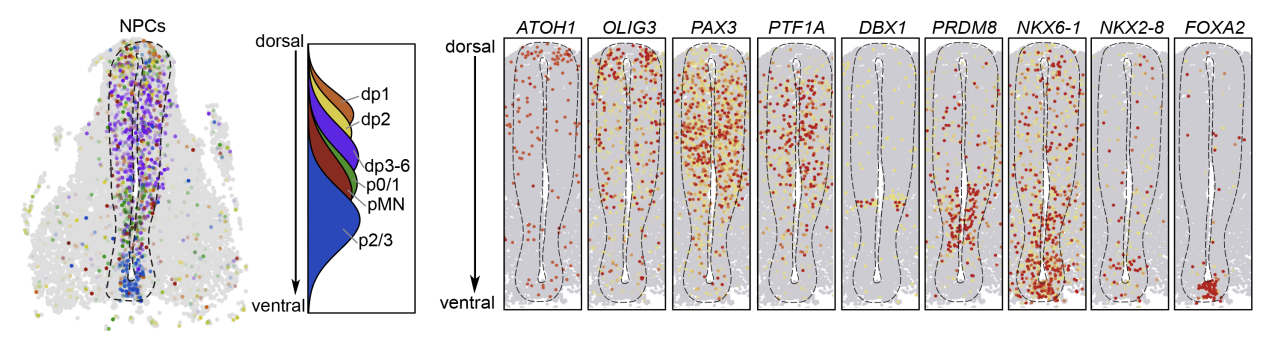
发育期人脊髓神经祖细胞和关键转录因子在背腹轴的空间排布模式
脊髓背角负责处理感觉信息,其神经元空间排布呈现出分层模式。不同层的背角神经元处理不同的感觉信息。但是有关脊髓背角发育及神经元有序排布的机制尚缺乏研究。在本研究中,借助于10X Visium 空间转录组,研究人员发现在人脊髓背角中存在早期(早于GW8)和晚期(晚于GW8)两波神经发生事件,并确定了GW8是关键的时间点。得益于空间信息的可获取性,本研究还揭示了早期和晚期产生的神经元分别定位于脊髓背角的深层和浅层,这对于解析脊髓背角神经元分层排布模式的建立机制有重要意义 (图3)。另外,通过联合分析scRNA-seq和10x Visium空间转录组数据,本研究进一步确定了早期和晚期产生的神经元的细胞身份。特别值得一提的是,本研究基于TF-seq FISH 数据首次报道了在人脊髓背角中瞬时存在由兴奋性和抑制性中间神经元所形成的三明治样(Sandwich-like)的细胞排布模式。这种Sandwich-like结构存在于所有脊髓节段中且在小鼠脊髓中也可以检测到,提示其可能在进化上是保守的。此外,本研究也解析了腹角运动神经元和脊髓星形胶质细胞多样性形成的分子及时空调控程序,并发现调控星形胶质细胞空间定位的分子机制和神经元在很大程度是一致的。

人脊髓背角神经元发生及空间排布模式图
另外,本研究在胚胎发育期的人脊髓中发现了一类与疾病相关小胶质细胞(Disease Associated Microglia, DAM)相类似的小胶质细胞(DAM-like microglia)。这类DAM-like小胶质细胞主要分布于人脊髓白质且其出现时间与人脊髓髓鞘发生时间相吻合,提示可能参与人脊髓髓鞘发生过程。scRNA-seq和ALS GWAS数据联合分析发现DAM-like小胶质细胞富集表达ALS致病基因,提示其可以作为研究ALS致病机制的新靶点,为研究和治疗ALS提供了新思路。

北京师范大学吴倩教授、王晓群教授和广东省智能科学与技术研究院时颖超研究员为文章的通讯作者。广东省智能科学与技术研究院时颖超研究员、中国科学院生物物理研究所博士研究生黄露苇、董豪和昌平国家实验室杨萌博士为文章的并列第一作者。
该工作得到了国家自然科学基金委、广东省高水平创新研究院项目、科技创新2030-“脑科学与类脑研究”重大项目、新基石科学等基金和项目的资助。



